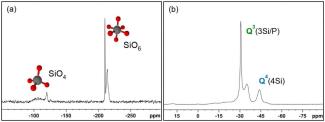
Tetraedrische und oktaedrische Siliziumkoordination in Silikophosphaten
Ansprechpartner: thomas [dot] vogt [at] chemie [dot] tu-freiberg [dot] de (Dr. Erica Brendler)
Silizium ist eines der häufigsten Elemente der Erde. In den meisten natürlichen Mineralen ist es tetraedrisch von Sauerstoff umgeben. Es gibt allerdings auch Minerale, in denen Silizium sechsfach koordiniert vorliegt. In den meisten dieser Verbindungen ist es dabei von Phosphatgruppen umgeben. Diese Silikophosphate weisen interessante Materialeigenschaften auf. Ihr hoher Brechungsindex macht sie für optische Anwendungen interessant, des Weiteren werden sie als Katalysatoren eingesetzt.
In Kooperation mit der Arbeitsgruppe von Prof. Kroke am Institut für Anorganische Chemie (AG Siliziumchemie und chemische Materialwissenschaften) werden neue Synthesen für Silikophosphate entwickelt [1-3]. Für die strukturelle Charakterisierung kommen vor allem 1D und 2D Lösungs- und Festkörper-NMR-Methoden zum Einsatz, wie Kreuzpolarisations- (CP) und Direktanregungsmessungen (SP), heteronukleare Korrelationsexperimente sowie Relaxationszeitmessungen.
In Kombination mit quantenchemischen Berechnungen, durchgeführt vom AK Prof. P. Kroll, Department of Chemistry and Biochemistry at the University of Arlington/ Texas, werden 29Si and 31P NMR Verschiebungstensoren berechnet und die Triebkräfte und Reaktionsbedingungen, die die Bildung von sechsfach koordiniertem Silizium unterstützen, untersucht.
Publikationen
- [1] Sandra Jähnigen, Erica Brendler, Uwe Böhme, Edwin Kroke; Silicophosphates containing SiO6 octahedra obtained from tetraalkoxysilanes, H3PO4 and P4O10 at ambient condition, New J. Chem. 38, 2014, 744-51; DOI: 10.1039/c3nj00721a
- [2] Sandra Jähnigen, Erica Brendler, Uwe Böhme, Edwin Kroke; Synthesis of silicophosphates containing SiO6-octahedra under ambient conditions – reactions of anhydrous H3PO4 with alkoxysilanes, Chem. Commun. 48, 2012, 7675-7677; DOI: 10.1039/C2CC31600E 2012; Cover
- [3] Sandra Jähnigen, Uwe Böhme, Gerhard Heide, Erica Brendler, Edwin Kroke; "Silikat-Phosphat-Materialien (SiOPS)"; DE 10 2012 011 034 A1 2013.12.05
BMBF Verbundprojekt „ProHapTox“
Entwicklung einer reaktivitätsbasierten Teststrategie zur tierversuchsfreien Erkennung des Hautsensibilisierungspotenzials elektrophiler und pro-elektrophiler Industriechemikalien im Rahmen der Chemikalienverordnung REACH
Der wichtigste Schritt bei der Hautsensibilisierung ist die Reaktion von kleinen Molekülen (Haptenen) mit Peptiden und Proteinen. Die daraus entstehenden Produkte werden vom Immunsystem erkannt, wodurch es zur Ausbildung von Kontaktallergien kommt. Zur Untersuchung von Haptenen wird heutzutage der Local Lymph Node Assay (LLNA) eingesetzt.[1] Bei diesem Verfahren wird eine große Anzahl an Versuchstieren benötigt. Daher ist es von großem Interesse alternative Methoden zur Untersuchung des Hautsensibilisierungspotentials von Chemikalien zu entwickeln. Unsere Arbeit beschäftigt sich mit der Untersuchung der Reaktion von Haptenen mit Peptiden und Proteinen. Zum Einsatz kommen dabei sowohl die NMR-Spektroskopie als auch die Massenspektrometrie. Mit Hilfe von NMR können das reaktive Zentrum und der Reaktionsmechanismus ermittelt werden. Durch die Reaktionsverfolgung und temperaturabhängige Untersuchungen werden Geschwindigkeitskonstanten und Aktivierungsenergien bestimmt. Die Massenspektrometrie wird vor allem verwendet, um Produktgemische und Mehrfachaddukte zu unterscheiden. Häufig wird hier aber wegen der geringen Löslichkeit einiger Substanzen der HPLC Chemoassay bevorzugt.[2]
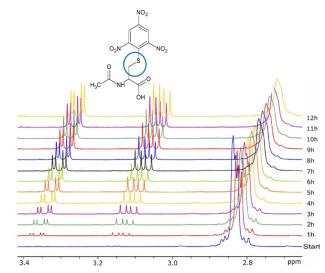
Partner:
- Institut für Organische Chemie, TU Bergakademie Freiberg
- Department Ökologische Chemie, UFZ Leipzig
Quellen:
- [1] Kimber I., Basketter D.A., FD Chem Toxic. 1992, 30,165-169.
- [2] Böhme A. et al., Chem. Res. Toxicol. 2009, 22, 742–750.